胡喜乐团队Nat. Catal.:立体选择性构建相邻C(sp³)立体中心
C(sp3)-C(sp3)键是构成大多数有机分子的主要骨架,特别是药物分子骨架中C(sp3)的比例和手性碳原子的存在对改善理化性质和药代动力学相关的临床疗效具有重要意义。如图1a所示,过渡金属催化的C(sp3)-C(sp3)交叉偶联是实现药物分子模块化合成的可靠工具,其中镍催化交叉偶联反应的快速发展使得该策略能够兼容更广泛的偶联试剂,包括各种外消旋烷基亲电试剂和亲核试剂。为了避免超化学计量金属试剂的使用,化学家利用镍-氢化物(Ni-H)催化实现了烯烃的加氢-烷基化,即金属氢化物插入烯烃并原位生成金属烷基物种,随后与烷基亲电试剂进行交叉偶联便可生成C(sp3)-C(sp3)键。然而,要想在Ni-H催化的加氢-烷基化反应中控制C(sp3)-C(sp3)键形成的立体化学却颇具挑战。近年来,化学家开发了外消旋烷基亲电试剂与烯烃的对映选择性交叉偶联反应或烯烃的对映选择性加氢-烷基化反应(图1b),但是利用这两种反应试剂来引入两个相邻C(sp3)立体中心的策略却没有报道过。尽管一些课题组在相邻手性碳的构建方面有所报道,但是反应的非对映选择性较差。
最近,瑞士洛桑联邦理工学院(EPFL)的胡喜乐教授(点击查看介绍)课题组报道了Ni-H催化内烯烃与外消旋烷基溴化物的对映和非对映选择性加氢烷基化反应(图1c),高立体选择性地构建了一系列C(sp3)-C(sp3)键。该方法利用两种不同试剂引入两个相邻的C(sp3)立体中心,成功地实现了一系列含有手性内酰胺、内酯、吡咯烷等骨架的潜在生物活性分子的合成(图1d)。相关成果发表于Nature Catalysis 杂志。
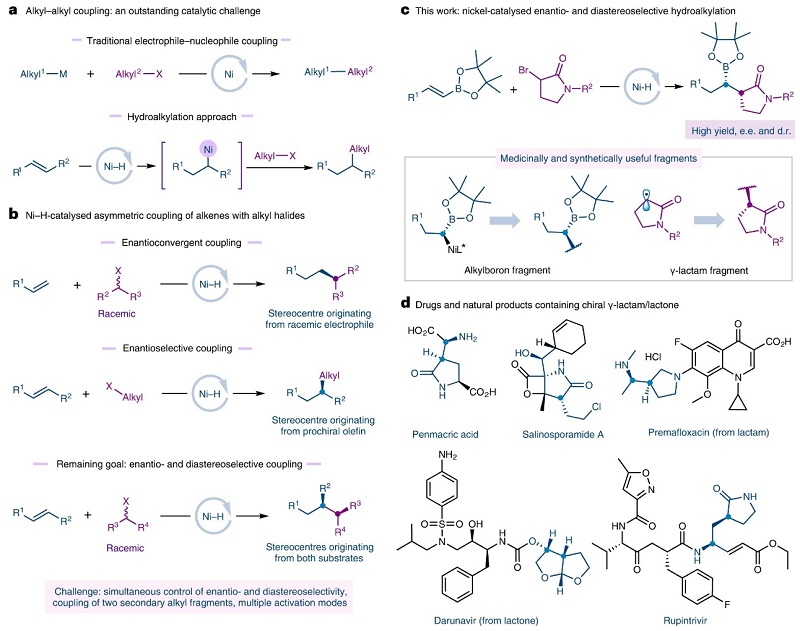
图1. 立体选择性C(sp3)-C(sp3)交叉偶联。图片来源:Nat. Catal.
首先,作者以烯基硼酸频哪醇酯1a和α-溴-γ-内酰胺2a为模型底物对立体选择性加氢烷基化反应条件进行优化(图2),并获得最佳条件:即1a和2a 在NiCl2(10 mol%)和对映纯mesityl-Bi-Ox(L2,15 mol%)为预催化剂、BF3•OEt2(30 mol%)为Lewis酸添加剂、(MeO)3SiH(2.5 equiv)为氢源、KF(2.5 equiv)为碱、LiCl(1.2 equiv)为额外的添加剂、N,N-二甲基乙酰胺(DMA)为溶剂的条件下于0 ℃反应45 h,能以75%的分离收率、94% e.e.值和95:5 d.r.值获得所需产物3aa。在条件优化过程中作者发现:1)Bi-Ox配体中的芳基取代基对立体选择性至关重要,而其它双齿和三齿手性氮配体(如:Py-Ox (L4)、Box (L5)和Py-Box (L6))并不能促进反应的进行;2)BF3•OEt2和LiCl的加入提高了反应的非对映选择性,而LiCl还提高了对映选择性。另外,对照实验表明锂阳离子和Lewis酸性硼试剂增强了反应的立体控制,作者推测BF3•OEt2与γ-内酰胺上羰基的配位作用以及Li+与BPin和羰基氧原子间的相互作用共同控制了反应的立体选择性。此外,LiCl可能增加了反应介质的离子强度,进而影响了反应的选择性。
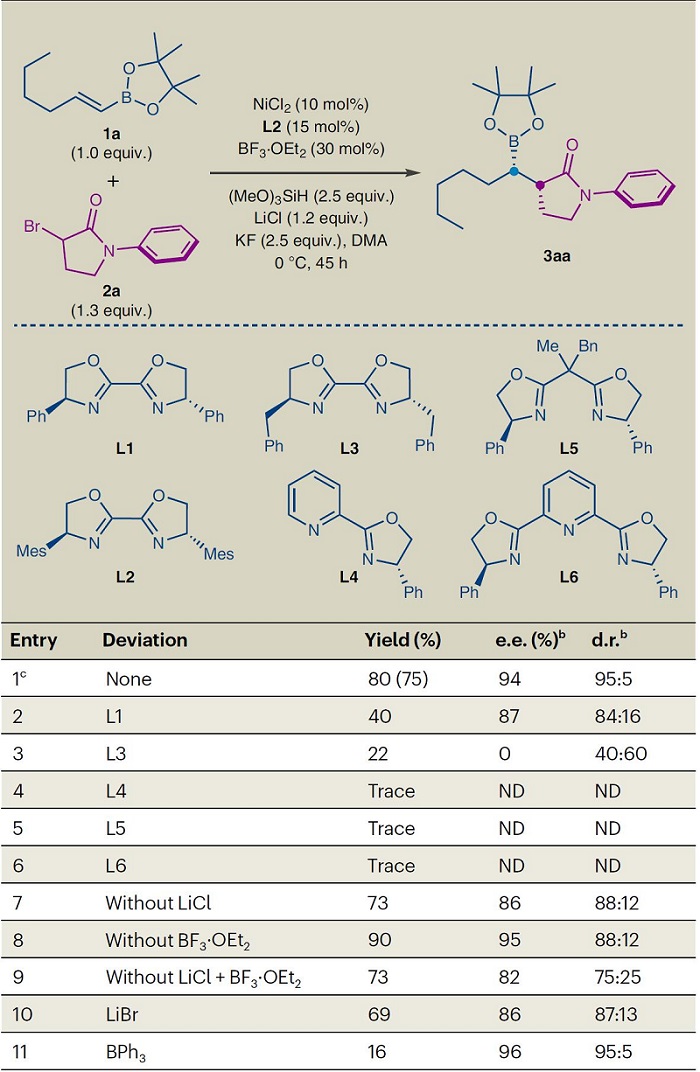
图2. 条件筛选。图片来源:Nat. Catal.
在最优条件下,作者对该反应的底物范围进行了考察(图3),结果显示多种不同结构的2-溴-γ-内酰胺均可兼容该反应,以中等至较好的收率和优异的对映选择性、非对映选择性获得相应的加氢-烷基化产物(3aa-3dq)。具体而言,γ-内酰胺氮上的芳基对位可耐受多种给电子和吸电子基团,例如:甲氧基(3ab)、氟原子(3ac)、三氟甲基(3ad)、三氟甲氧基(3ae)、酯基(3af)、羰基(3ah)、硼酸酯(3ag),而芳基邻位带有取代基时则会降低反应的非对映选择性(3ai-3ak)。N-杂芳基(3am)和N-烷基(3an-3dq)取代的2-溴-γ-内酰胺也能顺利进行反应,但氮原子上带有叔丁基时非对映选择性会显著较低(3dq),这表明内酰胺氮原子上取代基的立体位阻会影响反应的非对映选择性。此外,2-溴-γ-内酯也可以优异的产率、对映和非对映选择性获得加氢-烷基化产物(3dr-3ds),而无环2-溴酯类似物(3dt)的非对映选择性却较低,这表明环状底物对非对映选择性控制的重要性。其次,一系列烯基频哪醇硼酸酯(3ba-3oa)均能有效进行反应,并且可耐受多种官能团,例如:氯原子(3ea)、烷基醚(3fa-3ha)、硅醚(3la)、酯基(3ia、3ka、3ma、3na、3pa)、烷基腈(3ja)、芳基(3da)、邻苯二甲酰亚胺(3oa)以及药物相关的呋喃(3ma)、噻吩(3na)和四氢吡喃(3ia)等。值得注意的是,产物(3aa、3ab、3ad和3af)的绝对立体化学通过X-射线单晶衍射得到证实。
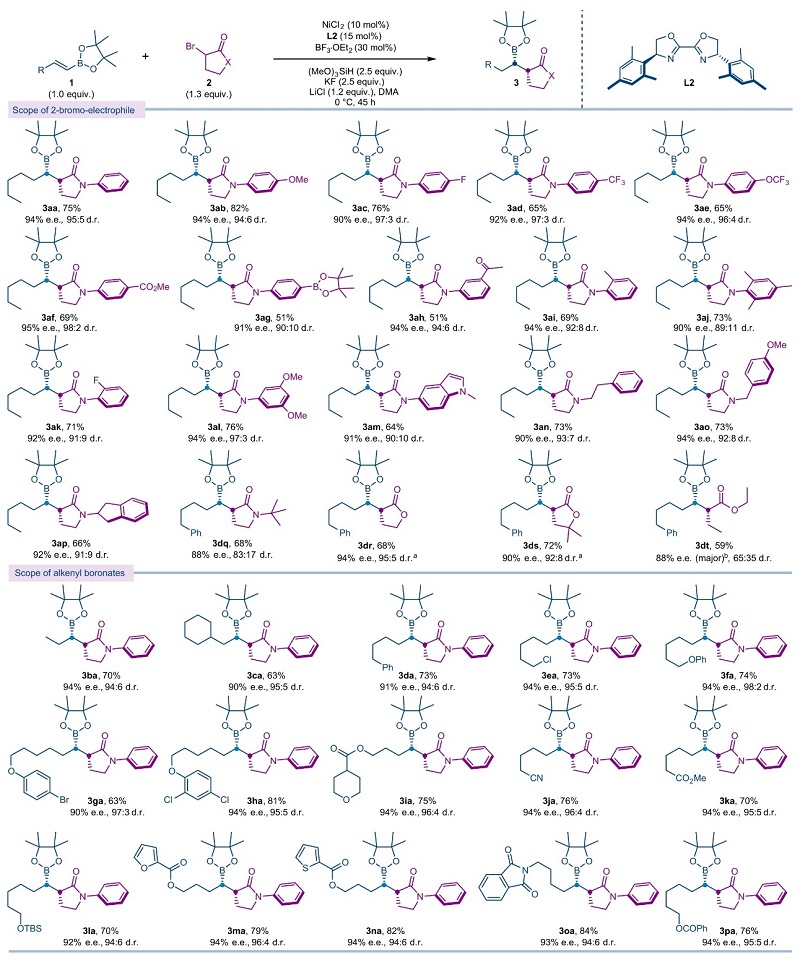
图3. 底物拓展。图片来源:Nat. Catal.
随后,作者通过一系列研究证实了这一全新的Ni催化烯烃的立体选择性加氢-烷基化方法学具有潜在的合成应用价值,例如:1)药物分子Chlorambucil、Oxaprozin、Probenecid、Isoxepac、Oestrone衍生的烯基频哪醇硼酯以及Lipitor中间体衍生的2-溴-γ-内酰胺均可顺利地实现转化(图4a),以良好的产率、优异的对映选择性和非对映选择性获得相应的加氢-烷基化产物(4-9);2)产物中的频哪醇硼酸酯可立体特异性地转化为乙烯基(10)、羟基(11)、羟甲基(12)、噻吩基(15)等(图4b),并且对映选择性和非对映选择性不会降低;3)3aa中的内酰胺骨架可以被还原成药物相关的吡咯烷(13);4)产物3dr 中的内酯环通过立体定向氧化和LiAlH4还原以两步66%的产率得到手性非环三醇(14);5)利用该方法还实现了两个抗抑郁药物分子的关键中间体(18)和(19)的合成(图4c)。

图4. 合成应用。图片来源:Nat. Catal.
为了进一步探究反应机理,作者进行了一系列实验:1)自由基钟实验(图5a)和自由基捕获实验(图5b)表明烷基卤化物活化后会产生烷基自由基中间体;2)产物3aa的非对映选择性和剩余原料2a e.e.值与时间的函数关系表明该反应是通过外消旋烷基卤化物的对映转化进行的(图5c),并非动力学拆分过程;3)氘代实验表明Ni-H物种插入烯烃是反应立体选择性的决定步骤(图5d);4)BF3•OEt2的加入提高了反应的非对映选择性,这可能是由于BF3•OEt2或反应中形成的另一物种会促使不同异构体之间的异构化过程,但作者通过控制实验排除了上述可能性(图5e)。在此基础上,作者认为该反应可能包含基于NiI/NiII/NiIII氧化还原转化的两种可能催化循环(图5f),具体而言:a)在Path 1中,NiI-Cl物种A通过单电子转移活化烷基溴化物并形成NiII-双卤化物B和α-羰基烷基自由基。随后,物种B与(MeO)3SiH反应得到NiII-H物种C,与烯烃发生迁移插入形成NiII-α-硼基-烷基中间体D,D捕获α-羰基烷基自由基形成NiIII-双烷基物种E,最后经还原消除便可得到偶联产物并再生NiI-Cl物种A;b)在Path 2中,NiI-Cl物种A优先与(MeO)3SiH反应并得到NiI-H物种F,与烯烃发生迁移插入形成NiI-α-硼基-烷基物种G,G活化烷基卤化物得到NiII-α-硼基-烷基中间体D和α-羰基烷基自由基。接下来,中间体D和α-羰基烷基自由基重组得到NiIII-双烷基物种E,再经还原消除便可得到偶联产物并再生NiI-Cl物种A。对于这两种催化循环,作者认为该反应的立体选择性源于对映选择性加氢-金属化过程得到手性Ni-α-硼基-烷基中间体以及NiIII-双烷基物种的非对映选择性还原消除。后面则通过Ni-α-硼基-烷基中间体可逆的Ni-C键均裂来诱导对映体转化过程。

图5. 机理研究。图片来源:Nat. Catal.
总结
胡喜乐教授课题组利用Ni-H催化烯烃与外消旋烷基溴化物的对映和非对映选择性加氢烷基化,高立体选择性地构建了一系列C(sp3)-C(sp3)键。该方法利用两种不同试剂引入两个相邻的C(sp3)立体中心,成功地实现了一系列含有手性内酰胺、内酯、吡咯烷等骨架的潜在活性分子的合成。该方法具有良好的底物适用性和官能团兼容性,并对天然产物衍生物的后期修饰和药物分子中间体的合成具有重要的研究价值。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantio- and diastereoselective construction of vicinal C(sp3) centres via nickel-catalysed hydroalkylation of alkenes
Srikrishna Bera, Chao Fan, Xile Hu
Nat. Catal., 2022, 5, 1180–1187, DOI: 10.1038/s41929-022-00894-0
导师介绍
胡喜乐
https://www.x-mol.com/university/faculty/2740
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号