金坚教授团队JACS:靶向p53的乙酰化双功能小分子研究的重要进展
随着化学诱导邻近(CIP)技术的进步,蛋白水解靶向嵌合体(PROTAC)领域已有10多种药物成功进入临床治疗疾病。受 PROTAC成功的启发,几种新的化学诱导邻近技术已经出现,通过诱导蛋白质翻译后修饰(PTM)来重新编程内源生物系统,从而有可能治疗具有挑战性的疾病。不断发展的 PTM-CIP 技术的例子包括去泛素酶靶向嵌合体 (DUBTAC)、磷酸化诱导嵌合小分子 (PHICS)、蛋白磷酸酶招募嵌合体 (PHORC) 以及诱导乙酰化的化学遗传学方法 (AceTAG)。然而,直接诱导内源细胞系统中靶蛋白(如p53)乙酰化的异双功能小分子(未经基因调控)却前所未见。
p53是一个拥有广泛而强大功能的抑癌基因。超过一半的肿瘤患者带有p53突变。p53基因敲除(KO)小鼠会在发育早期就形成肿瘤。自从1979年p53基因被发现以来,p53一直是分子生物学和肿瘤学的一个研究热门。目前恢复癌细胞的p53功能主要有2种策略:其一,对于p53野生型的癌细胞,抑制p53的负调节因子;其二,对于p53已突变的癌细胞,恢复p53活性。p53蛋白经常被认为是“不可靶向的”,因为wt-p53和突变p53都没有结合口袋或变构位点,不容易被小分子靶向。在有TP53基因突变的人类癌症中,75%是错义突变,主要发生在p53的DBD。这些热点突变的结构特征显示p53 Y220C中有一个可靶向的空腔,该突变通过DBD中热稳定性的丧失间接抑制DNA结合,一些小分子如PK9323被开发出来与p53 Y220C腔结合。虽然这类化合物已经证明了p53 Y220C的潜在靶向性,但没有一个达到生化效力或表现出WT水平的热稳定性,因此发展基于p53的乙酰化双功能小分子可能会成为一种新的潜在更优的癌症治疗策略。
在此基础上,通过分析p53Y220C-PK9323共晶体结构,金坚(Jian Jin)教授团队发现PK9323的甲胺暴露于溶剂,可用于连接接头。随后他们选择招募组蛋白乙酰转移酶p300 / CBP来诱导p53Y220C乙酰化,这主要是因为p300 / CBP高度表达并且是用于广泛底物的乙酰转移酶。为了招募p300 / CBP诱导乙酰化,选择使用p300 / CBP溴结构域的选择性小分子配体化合物33进行乙酰化靶向嵌合体(Acetylation Targeting Chimera, AceTAC)开发。通过酰胺键将不同的聚乙二醇(PEG)接头与PK9323的末端甲胺偶联,然后通过点击反应与化合物33的甲氧基连接,得到化合物1-4。化合物3 (PEG3) 和化合物 4 (PEG4) 在 5 μM 浓度下在24 h时适度增加 NCI-H1299 (p53Y220C, flag标记) 细胞系中 p21 的表达,而PK9323以及化合物1和2则没有。基于之前报道的PK9323 系列的SAR,作者通过保留胺基的NH(仲胺代替酰胺)设计了第二组 AceTAC,即化合物 5-9。他们惊喜地发现,与相同浓度的 PK9323 相比,化合物 5-9 使 p21 的表达增加了约 2 倍。其中5 μM 的化合物7 (PEG3) 在处理 8 h时诱导p53Y220C赖氨酸382 (p53K382ac) 乙酰化最为显著。通过这些初步研究,证明了他们的 AceTAC可以有效地乙酰化 p53Y220C 并诱导 p21 表达。
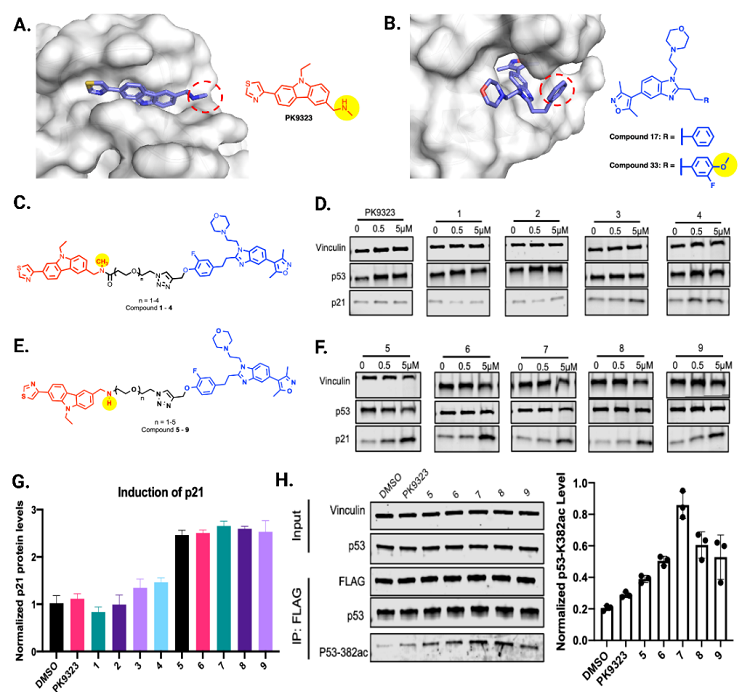
随后作者设想优化出一种更有效的p53Y220C AceTAC。先前报道4-甲基噻吩在PK9328中与p53 Y220C有更高的结合亲和力,受此启发,作者合成了4-甲基噻吩取代化合物MS78。发现MS78在10 μM浓度下24 h时诱导的p53K382乙酰化比化合物7多约2倍。由于MS78在诱导p53K382ac方面比化合物7更有效,因此他们选择将MS78为p53Y220C AceTAC的优选化合物,并对其进行进一步的生物学研究,表明 MS78 选择性结合 p53Y220C和CBP/p300 溴结构域,并以浓度和时间依赖性方式有效诱导 p53Y220C K382乙酰化。
接下来,作者进行内源 IP 实验以下拉 FLAG 标记的 p53Y220C,以评估在 MS78存在的情况下p53Y220C和p300 之间的三元复合物形成。他们用两种浓度的 MS78 处理 NCI-H1299 p53-null 和 NCI-H1299 p53Y220C 细胞,MS78可以在NCI-H1299 p53Y220C细胞中诱导p53Y220C和p300之间的相互作用,并以浓度依赖性方式诱导p53K382ac,而在NCI-H1299 p53-null细胞中没有观察到相互作用。为了进一步确认 p53Y220C K382 乙酰化依赖于 p300,他们在 NCI-H1299 (p53Y220C) 细胞系中使用 siRNA 敲低 p300,并监测 p53Y220C K382乙酰化。一系列的 FLAG-IP、敲低和拯救实验表明,MS78 可以诱导 p53Y220C 和 p300 之间形成三元复合物,并且 MS78 诱导的 p53Y200C K382乙酰化依赖于p300。
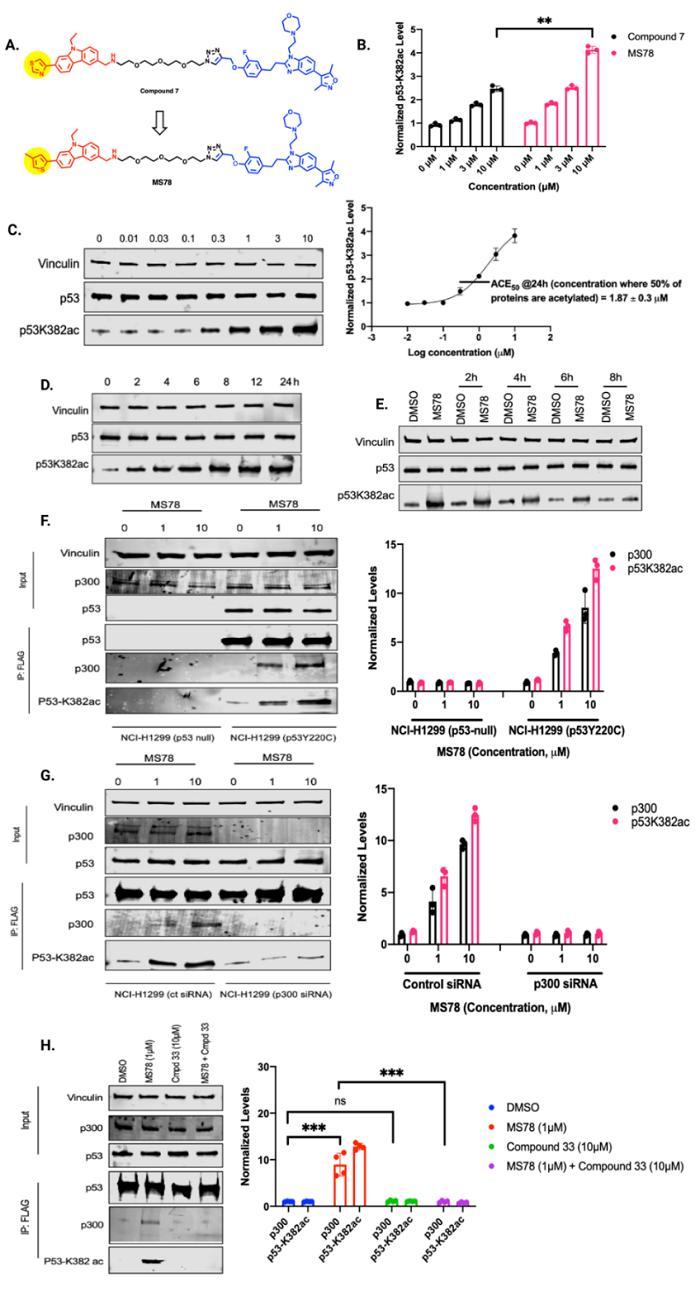
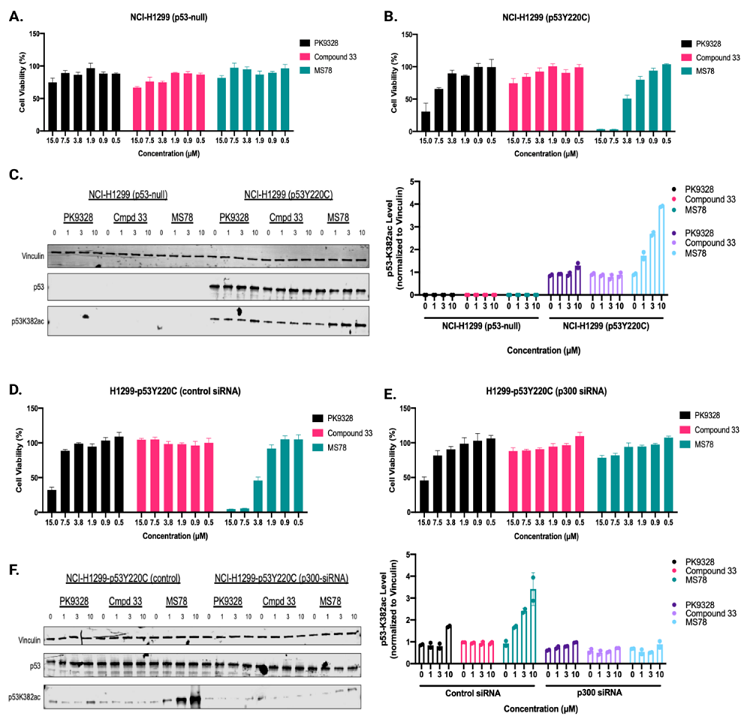
由于MS78以p300依赖性方式有效诱导p53Y220C K382乙酰化,作者假设MS78的抗增殖活性也依赖于p53Y220C和p300的存在。因此,他们评估了MS78对p53无效和表达p53Y220C的NCI-H1299同基因细胞系中细胞活力和对p53K382ac水平的影响,其中PK9328和化合物33作为对照。在 NCI-H1299 p53-null 细胞中,MS78、PK9328 和化合物 33 没有诱导任何显著的细胞生长抑制。另一方面,在NCI-H1299 p53Y220C细胞中,MS78浓度依赖性地抑制细胞生长,并且比p53Y220C稳定剂PK9328更有效地抑制细胞生长,而化合物33则没有效果。接下来他们证实,虽然MS78在NCI-H1299 p53-null细胞中不诱导K382乙酰化,但它在NCI-H1299 p53Y220C细胞中显著诱导K382乙酰化,而PK9328 和化合物 33 在任一细胞系中均未显著诱导 K382 乙酰化。这些结果表明MS78的细胞生长抑制作用依赖于p53Y220C和p300。
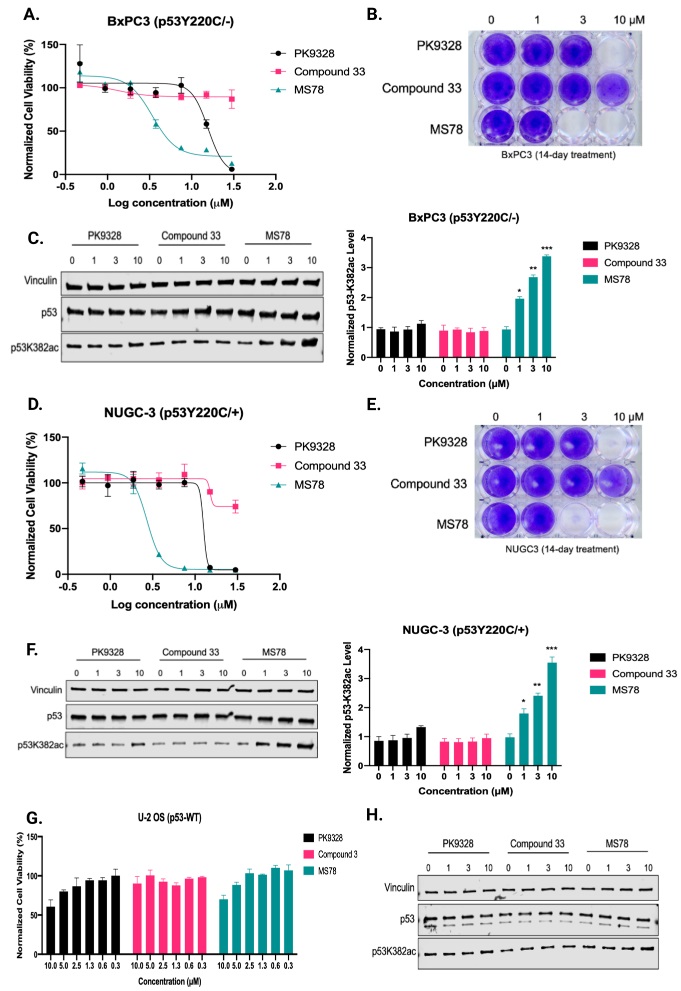
接下来作者考察了MS78在p53Y220C携带癌细胞系中的肿瘤抑制作用。MS78在BxPC3(p53Y220C/-)细胞和NUGC-3(p53Y220C/+)细胞中表现出有效的抗增殖活性。与母体化合物PK9328相比,MS78的效力高出约4倍,而化合物 33抗增殖活性最小。与细胞活力结果一致, MS78还在BxPC3和NUGC-3细胞系的克隆形成显著降低。MS78 优异的抗增殖作用可能是由于其乙酰化 p53Y220C K382 的能力(10 μM下p53K382ac水平增加约4倍)。作者随后评估了MS78在野生型(WT)p53癌细胞中的毒性。在p53 WT U-2OS癌细胞中,MS78和PK9328均未显著抑制细胞生长(GI50>10μM),这些化合物没有改变p53K382ac水平。这些结果表明,MS78的抗增殖活性对具有Y220C突变的癌细胞具有选择性,对WT p53和正常细胞几乎无活性,并且MS78可能是一种潜在的有用工具化合物,用于选择性靶向携带p53Y220C突变的癌细胞。
作者进行了 RT-qPCR 来评估 MS78 和 PK9328 处理后 p53 靶基因 mRNA 水平的变化,以比较p53Y220C K382乙酰化的效果与传统的 p53Y220C稳定剂对下游信号传导的差异。此外,还评估了MS78对调节细胞凋亡的基因的影响,发现BAX、PUMA(BBC3)和NOXA(PMAIP1)基因没有显著上调,与RT-qPCR结果一致。结果表明,p53Y220C K382乙酰化也可能促进细胞死亡通过诱导TRAIL基因的表达。令人惊讶的是,虽然MS78导致几个DDR基因如ATM、ATR和CHEK1 / 2的下调,但他们还发现了几种热休克蛋白基因的上调,如HSPA5、HSP40(DNAJB1)和HSP1A1/B。结合MS78治疗后血红素加氧酶1(HMOX1)和核蛋白1、转录调节因子(NUPR1)基因的上调,这些数据表明MS78可能通过上调HSPA5、HMOX1和NUPR1等关键基因来调节铁死亡反应。不过,仍需要进一步的研究来验证MS78诱导的p53Y220C K382乙酰化的下游靶标。
小结
在这项研究中,金坚教授团队介绍了 AceTAC 的开发。这是一种基于小分子的异双功能模式,通过劫持乙酰转移酶直接诱导 POI 乙酰化,无需任何基因操作。他们应用这项技术来靶向肿瘤抑制因子 p53 的 Y220C突变体,发现并表征了第一个 p53Y220C AceTAC——MS78——可以通过诱导 p53Y220C 和乙酰转移酶p300/CBP 之间形成三元复合物来有效乙酰化 p53。p53Y220C AceTAC MS78 在几种携带p53Y220C 的癌细胞系中表现出优于亲本 p53Y220C 稳定剂 PK9328 的抗增殖作用和抑制克隆形成作用,它诱导的癌细胞生长抑制作用依赖于p53Y220C和p300,对带有 WT p53 的癌细胞和正常细胞没有毒性。作用机制研究表明,p53Y220C AceTAC 诱导 TRAIL 和铁死亡基因并同时下调 DDR 通路。虽然有大量研究了解 WT p53 乙酰化的工作,但这是第一项使用化学工具检查赖氨酸乙酰化对 p53突变体功能的影响的研究。不过,还需要进一步的研究来充分表征 MS78 对携带 p53Y220C 的癌细胞中基因表达的调节作用;目前尚不清楚 MS78 是否会诱导除 K382 之外的其他赖氨酸残基上的 p53Y220C 乙酰化。总体而言,p53Y220C AceTAC MS78是进一步研究 p53Y220C 乙酰化在含有 p53Y220C 突变的癌症中的功能的有价值的工具化合物;AceTAC 可以提供一个潜在的通用平台,通过乙酰化作用靶向肿瘤抑制蛋白;此外,AceTAC可以进一步扩大异双功能小分子诱导的翻译后修饰领域。
相关工作近期发表于Journal of the American Chemical Society,共同第一作者为Md Kabir博士、孙宁博士和胡晓苹博士,通讯作者是金坚教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Acetylation Targeting Chimera Enables Acetylation of the Tumor Suppressor p53
Md Kabir, Ning Sun, Xiaoping Hu, Tiphaine C. Martin, Jingjie Yi, Yue Zhong, Yan Xiong, H. Ümit Kaniskan, Wei Gu, Ramon Parsons, and Jian Jin*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.3c04640
金坚教授简介
金坚,著名药物化学家, 美国国家发明家科学院院士,美国西奈山医学院冠名教授,西奈山医疗发展中心主任, 西奈山伊坎医学院药理学系、肿瘤和神经科学系终身教授,帝势癌症研究所癌症临床研究项目共同负责人之一;本科毕业于中国科学技术大学;博士毕业于宾夕法尼亚州立大学,师从著名有机化学家Steven M. Weinreb。金坚教授具有二十多年的小分子药物研发经验,是治疗慢性肾病的上市药物Daprodustat开发者之一,在国际药物化学界享有盛誉。曾任葛兰素史克(GlaxoSmithKline)公司药物化学部门总监、北卡罗来纳大学教堂山分校药物化学部副主任等职。
金坚教授课题组的研究方向主要为:(1)组蛋白甲基转移酶选择性抑制剂的发现;(2)G蛋白偶联受体偏向性配体的开发;(3)靶向肿瘤蛋白新型降解剂的研制。迄今为止已在相关领域发表200余篇SCI论文,包括Nature, Science, Cell, Nat. Med., Nat. Rev. Drug Discov., Nat. Biotechnology, Nat. Chem. Biol., Nat. Reviews Cancer, Cancer Cell, Nat. Cancer, J. Am. Chem. Soc., Angew. Chem. Int. Ed., Sci. Adv., Nat. Commun., J. Med. Chem.等;受邀进行100余次演讲;申请美国及国际专利70余项。
金坚
https://www.x-mol.com/university/faculty/311500
课题组主页
https://labs.icahn.mssm.edu/jinlab/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
“隔山打牛”:通过桥接蛋白靶向嵌合体(Bridged PROTAC)降解“不可成药”靶点 2022-12-13
-
金坚团队JMC:首例靶向LDH的PROTAC分子 2022-12-27
-
招募KEAP1实现目标蛋白质高选择性靶向降解 2021-10-09
-
雷晓光课题组发现通过新机制靶向p53通路的抗肿瘤天然产物候选药物分子 2020-01-31
-
The Lipid Metabolism as Target and Modulator of BOLD-100 Anticancer Activity: Crosstalk with Histone AcetylationDina Baier, Theresa Mendrina, Beatrix Schoenhacker-Alte, Christine Pirker, Thomas Mohr, Mate Rusz, Benedict Regner, Martin Schaier, Nicolas Sgarioto, Noël J.-M. Raynal, Karin Nowikovsky, Wolfgang M. Schmidt, Petra Heffeter, Samuel M. Meier-Menches, Gunda Koellensperger, Bernhard K. Keppler, Walter Berger


































 京公网安备 11010802027423号
京公网安备 11010802027423号